Količina supstance. Mol. Molarna masa
Atomi su čestice veoma malih dimenzija i mase. Da bi se uočila hemijska reakcija, potrebno je da bude veliki broj čestica koje reaguju. Broj čestica određuje fizička veličina koja se zove KOLIČINA SUPSTANCE. Količina supstance je jedna od sedam osnovnih fizičkih veličina. Oznaka za količinu supstance je n, a jedinica mol.
n[mol]
Po definiciji: 1 mol je količina supstance koja sadrži onoliko cestica koliko ima atoma u 12g ugljenikovog izotopa 12C, a to je 6*1023 čestica.
6*1023 broj se naziva još i Avogadrov broj (oznaka je NA). Znači, 1 mol bilo koje supstance sadrži 6*1023 čestica. Te čestice mogu biti :
- atomi,
- molekuli,
- joni… (O ovome ćemo malo detaljnije da radimo kroz zadatke.)
Na primer : 1mol lešnika sadrži 6*1023 lešnika.
1mol suncokreta sadrži 6*1023 zrna suncokreta.
Da vidimo šta ima veću masu, 1mol badema ili 1mol suncokreta? Očigledno je da masa 1mol lešnika veća jer je jedno zrno badema veću masu od 1 zrna suncokreta.
Isto tako mase 1 mol kalcijuma i 1 mol magnezjiuma nisu iste! Pogledajmo sliku:
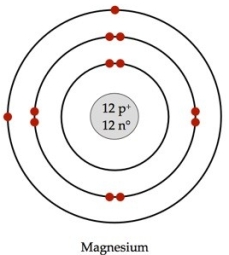
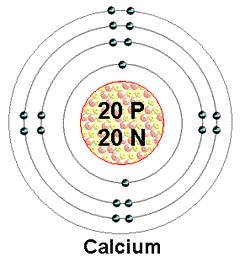
Primetimo da 1 atom Ca veći broj čestica (p+ i n0) od 1 atoma Mg , pa samim tim ima i veću relativnu atomsku masu (Ar). Kada želimo da izračunamo kolike su mase 1 mola Ca i 1 mola Mg, uvodimo novi pojam MOLARNA MASA.
Molarna masa jednostavno govoreći, predstavlja masu 1 mola bilo koje supstance. Oznaka je M, a jedinica g/mol.
M[g/mol]
Molarna masa supstance je odnos mase te supstance i njene količine.
М = m/n ,
gde je: M – molarna masa,
m-masa i
n- količina supstance
Molarna masa neke supstance se izračunava i tako što se relativna atomska masa pomnoži jedinicom g/mol. (ako je u pitanju atom, npr. Na)
M = Ar· g/mol za atome
Molarna masa neke supstance se izračunava i tako što se relativna molekulska masa pomnoži jedinicom g/mol. (ako je u pitanju molekul, npr. O2 )
M = Mr · g/mol za molekule
n = 4mol
Mr(Ca)=40 => M(Ca) =40g/mol
М = m/n => m = M*n
m(Ca) = 40g/mol *4mol
m(Ca)= 160g
n = 3mol
Mr(H2O)=2*Ar(H) + Ar(O) =2*1+ 16 =18 => M(H2O) =18g/mol
М = m/n => m = M*n
m(H2O) = 18g/mol *3mol
m(H2O)= 54g
n(C) =?
m(C) = 2.4g
Ar(C)= 12 => M(H2O) =12g/mol
М = m/n => n = m/M
n(C) = 2.4g / 12g/mol
n(C)= 0.2mola